
Als Grenzgängerin zwischen Pharma und Medtech beobachtet die Autorin, Katrin Rosen, seit mehr als 15 Jahren zahlreiche, mehr oder weniger zaghafte Initiativen, regulatorische Anforderungen global zu harmonisieren. Doch trotz ICH-Standards, IMDRF Publikationen, bi- und multinationaler Kooperationen und viel gutem Willen bleibt der Rechtedschungel vielfältig und für Hersteller häufig undurchdringlich. Empfehlungen finden ihren Weg in nationales Recht oft in verschiedensten Auslegungen, so dass die zugrundeliegende Idee der Annäherung ad absurdum geführt wird. Doch dann kam Corona.
Ausnahmezustand mit Folgen
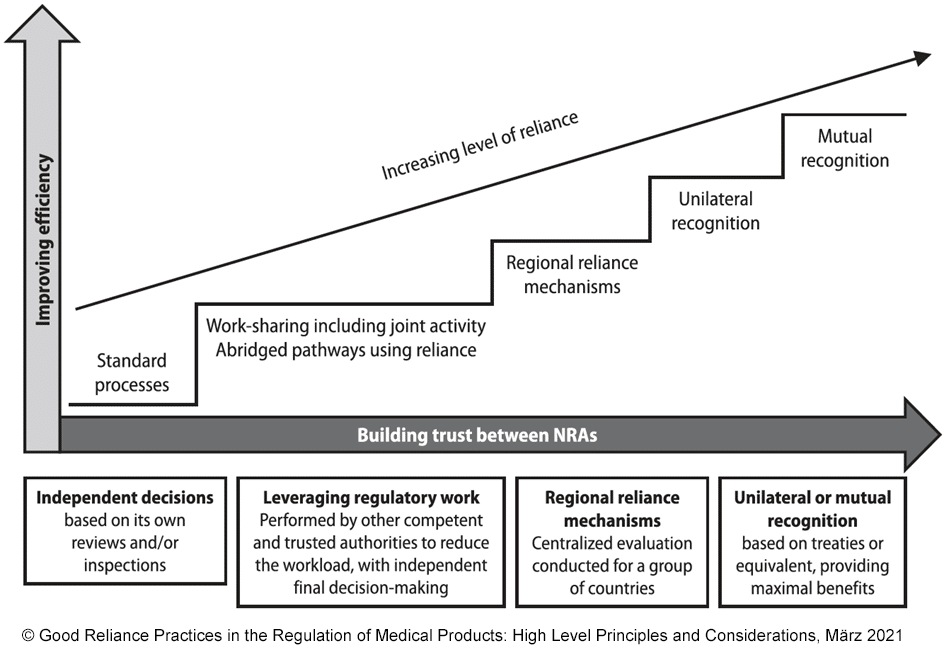
Noch nie hat ein Ereignis die globalen Gesundheitsbehörden so im Griff gehalten und alle bisherigen Prozesse in Frage gestellt wie die COVID-19 Pandemie. „Wenn wir etwas die letzten zwei Jahre gelernt haben, dann, dass Viren keine Grenzen kennen,“ so Katrin Rosen. Um der Bevölkerung ausreichend und schnell notwendige Arzneimittel, Vakzine und Medizinprodukte zur Verfügung zu stellen, wurden Kluften zwischen Staaten unbürokratisch überwunden und auf die Daten und Erfahrungen anderer Behörden zurückgegriffen. Was sich in einer Notsituation bewährt hat, ist auch ein Konzept für eine Welt nach der Pandemie. Diese Erkenntnis hat die internationale Zusammenarbeit der Behörden langfristig gestärkt. Und die Idee gemeinsame Kräfte zum Vorteil aller zu bündeln, bekam einen Namen und ein Konzept: Die Good Reliance Practices (GReP).
Impact für Arzneimittel- und Medizinprodukte-Hersteller?
Tatsächlich betrifft die Good Reliance Practices die Hersteller nicht direkt. Das Konzept richtet sich an Behörden, denen das Konzept hilft, die Arbeitsprozesse zu optimieren und Ressourcen einzusparen. Hersteller profitieren indirekt (und natürlich auch die Bevölkerung), wenn Produkte durch sog. Mutual Recognition Agreements viel schneller und unkomplizierter auf den internationalen Markt kommen können. Der Traum eines jeden Herstellers, im eigenen Land eine Marktzulassung zu haben und mit dieser in anderen Märkten verkaufen zu können, wird damit wahr. Aber: Auf die Behörden, die Prinzipien der GReP implementieren, haben Hersteller nur bedingt Einfluss – sie können über ihre Industrieverbände aktiv werden. Was sie jedoch selbst in der Hand haben und womit sie die Prozesse unterstützen können, ist die Aufbereitung ihrer Einreichungsunterlagen für die Länder, die eine Vereinbarung im Rahmen der GReP getroffen haben. Enthalten diese dieselben Informationen und denselben Stand kann die Behörde, die sich auf eine Referenzbehörde stützt, mit Sicherheit sagen, dass es sich um dasselbe Produkt handelt. Und das ist die Voraussetzung dafür, dass es dann im sog. Mutual Recognition Agreement wirklich schneller geht mit der Marktzulassung.
Weiter zum vollständigen Artikel von Katrin Rosen:
- Deutsche Version: https://www.reginta.de/media_de.html
- Englische Version: https://www.reginta.de/media_en.html
Über die Autorin: Katrin Rosen hilft mit ihrer RegIntAs Daedalus® Datenbank die gesetzlichen Bestimmungen aus den verschiedensten Ländern im Bereich Medizinprodukte und Arzneimittel zu erfüllen. Sie schafft für Kunden der Pharma- und MedTech-Branche Zugang zu gut aufbereiteten länderspezifischen, regulatorischen Informationen, wie z.B. Produktzertifizierung und Sicherheitsberichte












